|
29.06.11 | Notas Medicamentos de alto costo El sistema de obras sociales y el costo de la salud pública están sufriendo desde hace tiempo el embate de los denominados medicamentos de alto costo, destinados para un conjunto limitado de enfermedades que registran baja prevalencia, pero que demandan un volumen creciente de recursos financieros. Los medicamentos de alto costo no figuran en ningún manual, son medicamentos "ocultos" ajenos a cualquier control de precios. La consecuencia es que están desfinanciado las obras sociales sindicales, el Pami, las obras sociales provinciales y el sistema público de salud. Y cono están deliberadamente ocultos, tampoco aparecen en la facturación de la industria. Es a partir de esa baja prevalencia y su costo altísimo, que también se las conocen como "enfermedades catastróficas", pues generan un impacto económico a veces astronómico en las obras sociales y su atención requiere de ingentes recursos de la Administración de Programas Especiales (APE). En definitiva es el Estado , con una adecuada política sanitaria, el que debe garantizar la protección social de las enfermedades catastróficas, pues de lo contrario, se profundizarán las ineficiencias e inequidades del sistema, entre aquellas coberturas que pueden afrontar el impacto financiero y las que podrían excluir al paciente del tratamiento adecuado por no poder afrontar el costo. Una política de Estado debe ofrecer una respuesta homogénea para todos los beneficiarios de las obras sociales sindicales y también una respuesta segura y adecuada en cobertura médica para los afiliados de las obras sociales provinciales y del Programa Federal de Salud (Profe). Pero, además, se requiere de una política desde el Estado ante el escenario incierto que afrontan las obras sociales, que deben asumir el financiamiento de medicamentos de alto costo, promocionados por la industria como "revolucionarios", pero no siempre de comprobada eficacia terapéutica y que pueden terminar representando un asfixiante gasto de escasa efectividad. El principal factor que impulsa el alto costo de estos medicamentos es que son productos monopólicos, que tienen un único oferente y mediante la barrera de las patentes impiden que ingresen competidores al mercado. Tampoco son vendidos en farmacias minoristas ni figuran en las listas de precios, por eso se los conoce como "medicamentos ocultos". Estos medicamentos registran los mayores precios y muy baja sustitución, lo que origina que la demanda permanezca cautiva y la elasticidad del precio sea virtualmente nula. La mayoría son productos biotecnológicos y su facturación crece en todo el mundo a un ritmo que duplica el crecimiento anual del mercado farmacéutico en su conjunto, pues las ventas globales de este segmento se incrementan a un ritmo anual de 12,5 por ciento desde hace un lustro, contra el 6,4 por ciento de crecimiento del mercado en su conjunto. Por ejemplo, en 2007 existían 134 productos biotecnológicos y monopólicos con ventas superiores a 75 mil millones de dólares en el mundo. Al tope, se ubicaban 22 marcas comerciales "innovadoras" con ventas superiores a los mil millones cada una. En Argentina, esos medicamentos "ocultos" en las listas de precios, por su alto costo ya representan alrededor del 10 por ciento del total del gasto en salud. La Organización Mundial de la Salud define como "catastróficas" a las enfermedades cuyo tratamiento involucra un costo directo igual o superior al 40 por ciento del ingreso del hogar donde hay un paciente afectado. Una de las opciones para a amortiguar el gasto excesivo en medicamentos de alto costo es discriminar de forma positiva y explicita el abordaje de estas patologías catastróficas, lo que permitiría homogenizar la calidad de la atención y conseguir una mayor previsibilidad en gastos y apoyar la regulación de prestadores y prestaciones. En consecuencia, se lograría racionalizar el gasto y al mismo tiempo resolver el problema de la equidad en el acceso y la heterogenidad en la calidad de las prestaciones. Los principios fundamentales para abordar una estrategia de protección social de las enfermedades catastróficas deben estructurarse sobre la base de la efectividad, la eficacia y el modelo de financiación. La efectividad se sustenta en la medicina basada en la evidencia y sus avances, reduciendo la variabilidad de la práctica clínica e implementando modelos de atención adecuados a las necesidades. La eficacia implica regular desde la demanda, apuntando a la provisión de las necesidades sanitarias de la población, que será incorporada en forma gradual en la medida en que alcancen resultados en los niveles de eficiencia como para extender la cobertura y contener los costos. En cuanto al financiamiento para implementar este programa, debería crearse un Fondo Federal de Enfermedades Catastróficas, reservado para prestaciones médicas altamente especializadas, de demostrada efectividad, permitiendo que las mismas estén disponibles con equidad para toda la población del país. Ese fondo garantizaría un sistema de cobertura de máxima calidad y en condiciones de sostenibilidad económica y financiera, disponibles para todos los habitantes del país, hasta alcanzar una cobertura universal y la equidad de las prestaciones. Ese Fondo Federal, de implementarse, deberá recibir aportes del Ministerio de Salud y de otros financiadotes de la seguridad social y de los seguros privados que adherirán en forma voluntaria, siendo su aporte capitado de acuerdo al número de personas que se encuentre bajo su cobertura. También debe contemplarse la opción de que se incorporen las obras sociales sindicales y las prepagas al Fondo Federal de Enfermedades Catastróficas, participando de un seguro que garantizaría una respuesta homogénea en calidad para los afiliados, a un costo bajo, estable y previsible. El aseguramiento del sistema sería alcanzado en 2016 mediante acciones que se desarrollarán a partir de 2011 y que en 2012 presentarán una implementación efectiva de garantías explícitas en diez patologías seleccionadas. La primera etapa, que comenzaría en 2011, consistiría en definir las patologías que deben ser incluidas en el programa y la convocatoria a los diferentes sectores sociales involucrados en la iniciativa: el Ministerio de Salud, asociaciones científicas, sindicales, organizaciones no gubernamentales, entidades representativas de los consumidores, gobiernos provinciales. El Fondo Federal en su primera etapa deberá incluir las ocho patologías de muy baja prevalencia y muy alto costo, que se harán efectivas a partir de 2012: "fibrosis quistica, enfermedad de Gaucher, Enfermedad de Fabry, Enfermedad de Pompe, Enfermedad de Crohn, Tratamiento con Hormona de Crecimiento, Insuficiencia Renal Crónica y Tratamiento inmunosupresor post trasplante, La lista se iría ampliando cada año para otras patologías en base a estudios de carga de morbilidad y escenarios de incidencia y prevalencia hasta alcanzar la cobertura universal en 2016. La estructura administrativa requerida por el programa debería construirse a partir de un Acuerdo Federal de Extensión de Cobertura, consensuado en el COFESA (Consejo Federal de Salud). También deberían participar- desde una comisión administradora honoraria- el Ministerio de Salud, la SSS y el Ministerio de Economía, básicamente. También debería implementarse una Comisión de Efectividad Clínica que defina las patologías y los protocolos de inclusión e exclusión de los tratamientos de acuerdo a las evidencias científicas. Estos protocolos serán la piedra angular para la organización de un esquema de protección social de las enfermedades catastróficas y fortalecerá la viabilidad política del modelo universal, a semejanza de Uruguay (ver al final). Esa Comisión de Efectividad Clínica deberá revisar periódicamente la evidencia científica y llevará a cabo las modificaciones necesarias. También será responsable de seleccionar un segundo grupo de patologías para su inclusión a partir de la validación de los protocolos de acuerdo a la evidencia científica disponible y establecerá los costos de cobertura. También establecerá el cronograma completo de incorporación de patologías hasta el 2016 y el costo de la cápita a ser aportada por los diferentes financiadores. Cualquier sistema de cobertura a través de las obras sociales debe garantizar un finamiento sustentable, identificando las fuentes de financiación para la adquisición y provisión de los medicamentos de alto costo y definir previamente si los pacientes son incluidos como partícipes del modelo, mediante copagos, especialmente de los medicamentos de alto costo. Pero, la necesidad de construir un modelo sustentable implica también que resulte solidario y equitativo, pues la coparticipación en los gastos de medicamentos de alto costo puede generar un mecanismo de inaccesibilidad, salvo para "la crema" del sistema, o sea las obras sociales de personal jerárquico o los planes más caros de las privadas. En consecuencia, una política de regulación de precios debe apuntar al acceso al medicamento en el marco de un sistema financiero sustentable. Y en el caso de los medicamentos de alto costo que componen un segmento del mercado en que las empresas imponen las patentes y el monopolio, la única solución es la intervención directa del Estado. Hablamos, una ve más, de medicamentos que no figuran en las listas de precios ni se expenden a través del mostrador de una farmacia y que tienen valores astronómicos o catastróficos como indican las estadísticas que se expone en este mismo estudio (ver gráficos posteriores). Uno de los modelos atendibles de sustentamiento, es el Medicare Levy de Australia, un fondo nacional al que aportan todos los residentes, incluidos los inmigrantes y que representa el 1,5 por ciento del salario. Además el sistema incluye copagos, con suma fija de 11,80 dólares australianos, pero se contemplan montos diferenciales, ya que es menor para ancianos, discapacitados y desempleados, mientras que los estudiantes pagan un monto fijo de 1,90 dólares. En Alemania se exige un copago a cargo del paciente del 10 por ciento y en Canadá el monto del copago es reglamentado por cada provincia. El sistema norteamericano incluye también copagos que oscila según se trate del programa Medicare o de seguros privados y si brindan cobertura de medicamentos de marcas o genéricos. Por eso, algunos programas estadounidenses de medicina privada pueden ofrecer coberturas de hasta el 75 por ciento. En Inglaterra, el copago es del 35 por ciento, pero solo del 14 por ciento en recetas de medicamentos. Además, existe una regulación de precios que de aplicarse en Argentina sería calificada de "comunista" "estatista" y un ataque a la inversión privada, pues el Estado británico le impone a los laboratorios un tope en la rentabilidad por los nuevos medicamentos, calculado sobre el capital invertido en I+D. En Francia, el sistema de copagos varía de 15 al 100 por ciento, de acuerdo al costo del medicamento. Varios países han optado por fijar precios máximos y controles directos de precios. Pero los hay como Argentina y Colombia, que introducen valores de referencia para la seguridad social con cofinanciamiento, y los que fijan precios menores para medicamentos repetidos como Suecia, Brasil y Francia. Brasil además impone comparaciones de precios a nivel internacional y participó activamente con Argentina y el resto de los países latinoamericanos en la compra conjunta de medicamentos para el sida, que permitió ponerles límites a la rentabilidad empresaria. También existe el recurso del congelamiento de precios, que ha sido usado por países europeos como Alemania, Italia y España, pero también por Venezuela y Panamá. En resumen, la mayoría de los países europeos, Australia y Canadá, ha incorporado en forma progresiva diversas medidas de racionalización y contención del gasto farmacéutico. Estas medidas han incluido los controles de precios, que en América Latina fueron abandonados en la década del 90 y que desde entonces gozan de escaso predicamento en la región. Los mercados latinoamericanos con regulaciones, heterogéneas por otra parte, son Brasil, Ecuador, Nicaragua y Paraguay, y hay sistemas mixtos en Venezuela y Colombia. La conclusión es que el control estatal sobre los precios en América Latina es muy limitado y en la mayoría prosigue funcionando "el mercado", por más de la presión de algunos funcionarios estatales, ya sean ministro de Salud y Economía o secretarios de Comercio. DIFERENCIAS DE PRECIOS ENTRE ARGENTINA, CHILE Y ESPAÑA Por ejemplo:
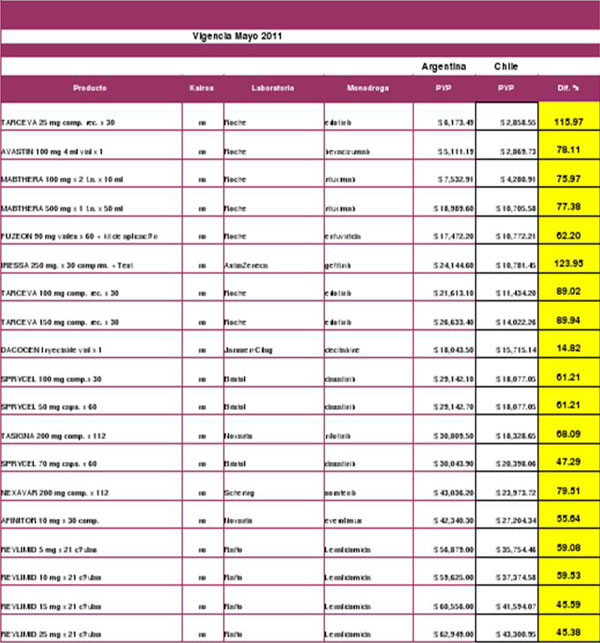
Las diferencias entre los mercados de Chile y Argentina son las siguientes:
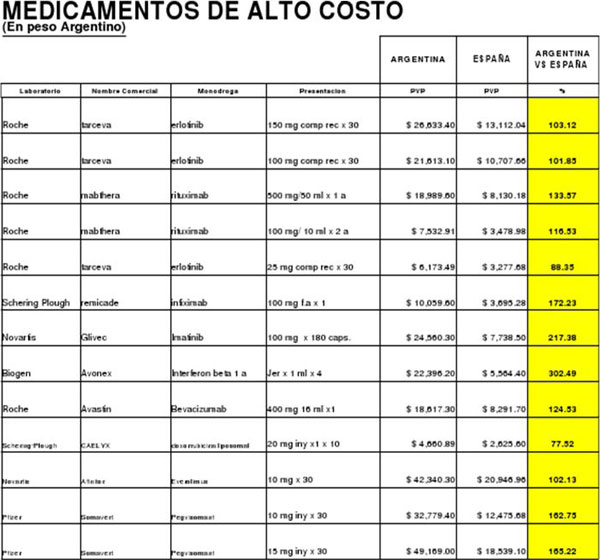
ESPAÑA Y ARGENTINA, DIFERENCIAS DE HASTA 300 % Por ejemplo, el Biogen (Interferon Beta) 1ml x 4 de Avonex, registra una diferencia de 302,49 por ciento, entre el precio en España donde cuesta el equivalente a 5.564,40 pesos y nuestro país, donde se comercializa a 22.396,20 pesos. Glivec (imatinib) 100 mg x 180 cápsulas de Novartis se consigue en España al equivalente de 7.738,50 pesos, mientras que en Argentina cuesta 24.560,30 pesos, una diferencia de 217,38 pesos. También en España el Remicade (infiximab) de Schering Plough 100 mg x 1 cuesta el equivalente a 3.695,28 pesos, mientras que en Argentina se vende a 10. 059, 60 pesos, 172 por ciento más caro. Somavert (pegvisomant) en sus presentaciones de 10 mg y 15 mg x 30 iny de Pfizer cuestan en Argentina 162,75 y 165, 22 por ciento más caro que en España, respectivamente, pues las presentaciones en Madrid se consiguen a 12.475,68 y 18.539,10 pesos, mientras que en Argentina se venden a 32.779,40 y 49.169,10 pesos. Mabthera (rituximab) de Roche también registra diferencias de 116,53 a 133,57 por ciento, pues en España cuesta 8.130,18 pesos la presentación de 500mg/50 ml x 1 mientras que en Argentina se vende a 18.989,60 pesos (133,57 %). La presentación de 100mg/10 ml x2 cuesta en España 3.478,98 pesos y en Argentina 7.532,91 pesos (133,57 %). También las diferencias oscilan de 101,85 y 103,12 por ciento en el Tarceva de Roche y es de 102, 13 por ciento para Afinitor de Novartis, entre los mercados de ambos países. En España Novartis vende su producto en la presentación de 100 mg x 30 a 20.9498 pesos mientras que en Argentina se comercializa a 42.340,30 pesos. El Iressa 250 mg x 30 comprimidos de AstraZeneca tiene un costo en Argentina de 24.144,60 pesos, mientras que en España se vender al equivalente de 12.019,37 pesos. También la diferencia es considerable en el Targretin 75 mg x 100 cápsulas (Biorofarma) pues en el mercado español se comercializa a 7.204,75 pesos y en Argentina cuesta 25.195,10 pesos. Tasigna de novartis en su presentación de 200 mg x 112 cuesta en Argentina 30.809,50 pesos, mientras que en España se vende al precio equivalente de 20.958 pesos. Tracleer 125 mg x 56 comp de Biotoscana cuesta en Argentina 25.894,30 pesos, pero en España se consigue al equivalente a 13.016,74 pesos. El detalle de las diferencias apuntadas es el siguiente:
La lista de medicamentos de alto costo existentes en el mercado argentino, incluye los siguientes productos: MEDICAMENTOS DE ALTO COSTO-MAYO 2011
ESPAÑA BUSCA EL CONTROL Como consecuencia de la crisis, el gobierno español a fines de 2010 dispuso un recorte de precios para contener el gasto en medicamentos de 12.693,7 millones de euros al año sólo en recetas facturadas al Sistema Nacional de Salud y 60 mil millones de euros en el presupuesto sanitario autonómico. El recorte consistió en la rebaja de precios y descuentos del 7,5 por ciento en el importe de denominados "fármacos innovadores" con patentes, o sea esos que en Argentina son conocidos como de alto costo y "ocultos". El Ministerio de salud también fijó en 7,6 por ciento del precio de venta del medicamento, el margen de correspondiente a la distribución de aquellas presentaciones que no superen los 91,63 euros. Para las presentaciones que superen ese precio, el margen admitido es de 7,54 por ciento por unidad y para los medicamentos de fabricación industrial y envase clínico, el porcentaje tope fijado por ley es de 5 por ciento. La medida se ha traducido en una inmediata reducción del gasto en 2,67 por ciento en la partida presupuestaria del 25 por ciento que consumen los medicamentos de alto costo "innovadores" en España, del gasto global autonómico sanitario. El Real Decreto de España también impone para las farmacias un margen del 27 por ciento del precio de venta al público para los medicamentos con un precio de hasta 91,63 euros y un margen de 38,37 euros por envase para los que superen ese valor. Para los medicamentos a cargo de los fondos públicos, se fijo una escala de deducciones que comienza en 8 por ciento y avanza hasta el 15 por ciento, para los medicamentos de mayor costo. Además, cuando se trata de medicamentos de venta libre y "publicitarios", se introduce una reducción del 10 por ciento. Todas estas medidas fueron acompañadas además de indicaciones precisas sobre el uso racional de todos los productos sanitarios. RESTO DEL MUNDO En Alemania el proceso de evaluación está a cargo del Instituto Federal de Medicamentos y Dispositivos Médicos que ejerce la farmacoviligancia y la evaluación debe repetirse obligatoriamente cada cinco años. Para la seguridad social, en Alemania existe un denominado "fondo de enfermedades" que paga por todos los medicamentos prescriptos, más allá del precio, una vez que fueron autorizados. Pero todavía no existe una definición sobre los medicamentos de alto costo, aunque existe un proyecto de incorporar estudios de costo-efectividad a las evaluaciones obligatorias. En Australia los medicamentos incluidos en la seguridad social deben ser aprobados por el Therapeutic Goods Administración que integra el Ministerio de Salud y que es el organismo encargado de las pruebas de eficacia, seguridad y calidad. Estos medicamentos luego de obtener la aprobación son incluidos en el Australian Register of Therapeutics Goods que otorga subsidios a la población a través del Pharmaceutical Benefits Écheme (Plan de Beneficios Farmacéuticos)). Los nuevos medicamentos, sin son más caros, deben demostrar que poseen propiedades terapéuticas superiores o adicionales a los ya existentes en el Plan de Beneficios Farmacéuticos, para conseguir que se los incluya. Desde 1993 se exigen estudios de costo-efectividad para la inclusión de una droga. Además, existe un comité de evaluación (Pharmaceutical Benefits Advisory Comitee) integrado por médicos, farmacéuticos y consumidores que recomienda al Ministerio de Salud que drogas incorporar al Plan de Beneficios farmacéuticos. Sin esta recomendación, el Ministerio de Salud no puede incluir nuevos productos, pero se reserva la facultad final de rechazarlos. El actual listado del Plan de Beneficios Farmacéuticos incluye 638 drogas y 2036 marcas comerciales. Los de venta libre no están cubiertos. En Brasil el sistema de regulaciones gira en torno a la agencia Anvisa dependiente del Ministerio de Salud, similar a la ANMAT de Argentina. Además existe una Comisión de Regulación Económica y una Comisión de Evaluación de Tecnología, que definen la incorporación de nuevos medicamentos a los programas de seguridad social subsidiados por el Estado. En Canadá existe un modelo de cobertura a nivel nacional implementado por la Canadian Agency for Drugs and Technology in Health y los medicamentos de alto costo son provistos por el Estado. Estos medicamentos son seleccionados por la Comisión del Formulario Terapéutico Nacional de Medicamentos dependiente del Ministerio de Salud, dirigido por el Centro para el Desarrollo de la Farmacoepidemiología. Actualmente el sistema canadiense incluye 856 medicamentos de alto costo y la lista se define en reuniones periódicas de la Comisión del Formulario Terapéutico y el Ministerio de Salud, en las que participan los especialistas del Centro para el Desarrollo de la Farmacoepidemiologia. El Ministerio de Salud puede adquirir medicamentos directamente, como medida de excepción y con la debida justificación. El proceso de aprobación de los nuevos medicamentos en Canadá es responsabilidad del Health Product and Food Branch, una agencia dependiente del Ministerio de Salud que evalúa la eficacia y la seguridad de las drogas. En Francia, existe la Agencia Francesa de Seguridad Sanitaria de los Productos Sanitarios que valora la utilidad y eficacia de los nuevos medicamentos. El Ministerio de Salud a su vez decide si esos fármacos justifican ser reembolsados por el seguro social. Francia posee un sistema de financiamiento mutualizado para los gastos en salud, pues es asumido por un seguro de enfermedad obligatorio, pero al mismo tiempo es uno de los países con menor reembolso en medicamentos. En Inglaterra, la Medicine and Healthcare Products Regulatoy Agency (MHRA) del Ministerio de Salud evalúa la seguridad, calidad y eficacia de los medicamentos y la tecnología sanitaria. A través de esa agencia existe un riguroso sistema de aprobación de nuevas drogas y una fuerte protección de las mismas a través de las patentes. El sistema de aprobación incluye evaluaciones sobre costo-efectividad de las drogas novedosas y eventualmente se recomienda su inclusión en la seguridad social. Además existen un sistema de regulación de precios, compartido en un organismo denominado PPRS en sus siglas en inglés, integrado por el Ministerio de Salud y la Asociación de Industria Farmacéutica Británica. La regulación la realiza el Estado a partir de un tope en la rentabilidad sobre el capital invertido en I+D y gastos de comercialización. En Suiza, funciona la Agencia Suiza para Productos Terapéuticos encargada de autorizar y supervisar los nuevos medicamentos y evaluar su calidad, seguridad y eficacia. En Colombia funciona la Comisión Técnica Asesora en Medicamentos del Consejo Nacional de Seguridad Social en Salud, integrada por colegios profesionales y especialistas médicos en terapias complejas, que establece criterios y recomendaciones para la actualización del listado de los medicamentos con cobertura de las obras sociales y ordena estudios de costo-efectividad. Esta comisión funciona a modo de filtro pues es la que ordena la evaluación de la evidencia científica disponible para justificar la cobertura de la seguridad social para los medicamentos que ingresan al mercado. En Colombia funciona además el programa "Tienda Segura" que ofrece capacitación en buenas prácticas de dispensación de un grupo muy reducido de medicamentos y aplica auditorias permanentes. Incluso, existe en ese país un programa de recolección de medicamentos vencidos, en el marco de una estrategia nacional de uso racional de fármacos. El concepto dominante en el sistema de seguridad social de Colombia es fortalecer el vallado previo a la inclusión de nuevos medicamentos, pero admitiendo aquellos que aún con costo alto, justifican beneficios terapéuticos para los pacientes. CONTROL DE PRECIOS Brasil impone también un techo para los precios calculado en función de varios índices de costos industriales y en Canadá los precios de mercado son fijados por el Patented Medicine Prices Review Borrad un organismo independiente y cuasi-judicial. Colombia posee tres regímenes de regulación: libertad vigilada (para la mayoría), libertad regulada (sida, por ejemplo) y control directo, aplicable este último para los que ingresan al mercado con un precio superior al valor de referencia. Ecuador hay un sistema de control de precios que establece un margen máximo de rentabilidad del 20 por ciento, calculado sobre los costos y gastos declarados por las empresas farmacéuticas. El órgano que decide los valores es el Consejo Nacional de Fijación y revisión de Precios de Medicamentos de Uso Humano integrado por los ministerios de Salud, Comercio Exterior, Industria y un delegado de la Federación de Químicos Farmacéuticos. Inglaterra también aplica un índice máximo de ganancias que es calculado sobre el total de la facturación del listado de un laboratorio y no sobre cada medicamento en particular. Hasta Honduras posee topes de precios para limitar la ganancia de los laboratorios y funciona un Consejo Consultivo Multisectorial del Medicamento integrado por el Ministerio de Salud, el Instituto Hondureño de Seguridad Social, las secretarías de Salud, de Industria y Comercio, el Consejo de Defensa del Consumidor, la Asociación Nacional de Productores farmacéuticos y Drogueros, y la Asociación de Propietarios de Farmacias. Venezuela ha introducido un sistema mixto entre precios regulados y libres, pero es el Estado, en última instancia, el que establece los precios máximos a través de un sistema de márgenes de ganancia. Desde Australia a Honduras, las experiencias precedentes indican que las regulaciones son indispensables y mecanismos indispensables en manos del Estado. Y nadie denuncia sovietización, castrismo, estatismo, burocratismo o injerencia en la propiedad privada. Sin embargo, un proyecto que reunía muchas de estas experiencias ajenas, de la diputada Patricia Vaca Narvaja, que intentaba fijar límites de rentabilidad y explorar los costos reales de los laboratorios, desde el precio a granel de los insumos importados declarados en la Aduana al mostrador del farmacéutico, fracasó en el Congreso Nacional que nunca se digno a discutirlo. La legisladora no era una descolgada, ya que contó con el asesoramiento de farmacéuticos, visitadores médicos y expertos en economía de la salud. Esa experiencia internacional indica que los controles de precios son difíciles de aplicar cuando se carecen de economistas especializados al servicio de los programas sanitarios o de sistemas de información confiables en el segmento de la producción y la comercialización, pues es la industria la que impone sus balances. Cuando se carece de esa información, los medicamentos de alto costo ingresan al mercado latinoamericano con un precio superior al que consiguen en los países desarrollados, donde sí hay indagaciones efectivas sobre los costos ocultos, tal como indicó la comparación entre Argentina y España. POR FIN, URUGUAY El programa uruguayo prevé que los medicamentos de alto costo incorporados a la cobertura del Fondo Nacional de Recursos requieren previamente de un informe técnico favorable de la Comisión Técnico Asesora, que pedirá una evaluación económica en términos de costo-efectividad y el impacto financiero en los recursos del mencionado fondo. El Fondo Nacional de Recursos dispuso de una guía de procedimientos para los medicamentos de alto costo con cobertura, destinada a los médicos y las entidades prestadoras. Esa normativa establece criterios de inclusión y la obligación de estudios clínicos personalizados. La finalidad era definir la necesidad o no de un paciente respecto a determinado medicamento de alto costo. El sistema uruguayo impone como requisito la evidencia científica para la inclusión de estos medicamentos, avalada por profesionales responsables "con independencia técnica y económica". El médico tratante deberá firmar además un protocolo indicando que no recibe ninguna forma de remuneración de parte del laboratorio que suministra el medicamento y se exige una segunda opinión, por parte de otro profesional. En los fundamentos del programa promulgado por el gobierno uruguayo –el debate se inició en septiembre de 2007 con Tabaré Vázquez-, se resalta que "el alto impacto en los costos ha conducido a un nuevo abordaje de la equidad al ser necesaria una visión desde los valores de la ética y de la justicia distributiva, ampliando el debate por fuera del ámbito estricto del sector salud y llevándolo al debate social". "El tema de los medicamentos de alto costo irrumpió en nuestro escenario social como una necesidad desde la población y fue necesario darle una respuesta organizada", agregó el gobierno uruguayo al promulgar el programa. Al presentar el proyecto ante el parlamento, Miguel Fernández Galeano, subsecretario de Salud y presidente del Fondo Nacional de Recursos, denunció que una de las artimañas de la industria para imponer sus productos eran "las estrategias de comunicación e implantación de gran despliegue, desarrolladas por una industria farmacéutica en general muy relacionada con grupos restringidos de especialistas y con asociaciones de pacientes". "Existen numerosos ejemplos de tratamientos que luego de haber sido impulsados con entusiasmo por proveedores y especialistas, debieron ser desaconsejados cuando se dispuso mayor información respecto a la evolución de los pacientes", acertó el funcionario. Sus palabras fueron también de agradecimiento a quienes aportaron estudios comparados sobre medicamentos de alto costo y regulaciones en el mundo, entre los que mencionó al argentino Federico Tobar. Tobar fue quien durante el estudio del proyecto, aportó información sobre la experiencia internacional y la "judicialización" de las coberturas, por demandas de pacientes alentados y asesorados por abogados contratados por los laboratorios, que en esos momentos afloraban en Argentina. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||