|
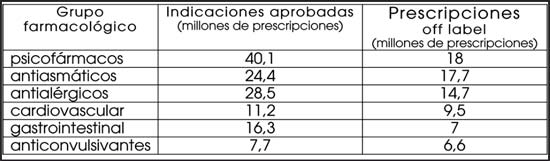
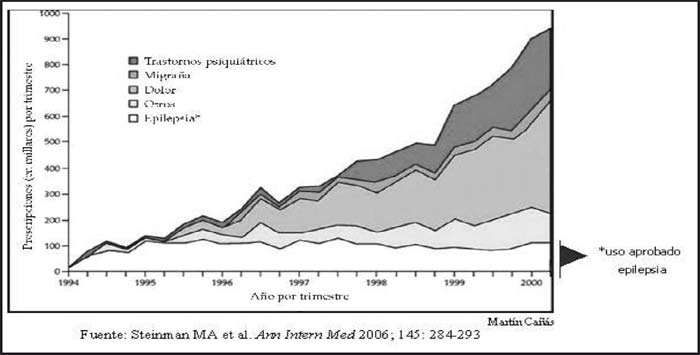
01.04.10 | 2do Informe de Investigación La promoción de medicamentos para indicaciones no aprobadas (“off label”) En este artículo se examinará brevemente la promoción por fuera de las indicaciones aprobadas a través de dos casos resonantes que tuvieron difusión pública por los procesos judiciales que se llevaron adelante en Estados Unidos. Una introducción sobre los usos no aprobados Aunque la aprobación de un nuevo medicamento es específica para determinadas indicaciones del producto, una vez que el medicamento ingresa en el mercado, las agencias reguladoras están limitadas para ejercer la fiscalización de su uso adecuado. El uso “off label” se podría definir como “la prescripción de un fármaco para una indicación o una forma diferente a la aprobada por la agencia reguladora”. Pueden considerarse sinónimos “uso en indicaciones no aprobadas” o “uso por fuera del prospecto”. Puede implicar el uso de un medicamento para una indicación no aprobada (por ejemplo, risperidona, un antipsicótico, en el tratamiento de la depresión; metformina para el caso de ovario poliquístico), o bien en poblaciones para las que no está aprobado (el ejemplo clásico es la paroxetina en niños). El uso “off label” no es ilegal y es bastante frecuente en determinadas especialidades. Sin embargo, en caso de que aparecieran efectos adversos, implica mayores responsabilidades, principalmente legales, para el prescriptor. Esto es así porque los medicamentos se autorizan para determinadas indicaciones de acuerdo a las pruebas adecuadas de su eficacia y seguridad. Para el resto de los posibles usos o indicaciones se considera que al carecer de una revisión científica rigurosa, no hay datos que avalen su uso de manera razonable. Este es un proceso dinámico y a través del aporte de datos provenientes de nuevos ensayos clínicos, a futuro se puede considerar la aprobación para otros usos. El uso de fármacos en indicaciones no aprobadas En 2006 se publicó un estudio realizado en base a los informes del año 2001 del Índice de Datos de Diagnósticos y Terapias del IMS (NDTI por sus siglas en inglés) sobre el uso en indicaciones no autorizadas de 160 fármacos de uso frecuente. Se encontró que el 73% de las prescripciones por fuera del prospecto se realizaban sin que existieran pruebas de su eficacia clínica, y que desde el punto de vista científico sólo estaban justificadas en el 27% de los casos. Los antipsicóticos y los antidepresivos tenían una probabilidad especialmente elevada de ser usados en indicaciones no aprobadas. La industria farmacéutica en Estados Unidos no podía promover sus productos para indicaciones no aprobadas por la Agencia de Alimentos y Medicamentos (FDA, por sus siglas en inglés) pero determinadas personas (catalogadas de “expertos” y aparentemente independientes de las compañías) sí podían promoverlos.
Las normas actuales de la FDA prohíben la promoción directa (por el laboratorio productor) de medicamentos para indicaciones no autorizadas. Sin embargo, la industria farmacéutica puede facilitar el uso en indicaciones no aprobadas, aprovechando la ambigüedad cuando las normas son permisivas, no están bien definidas o no se aplican. Así, la ley de modernización de la FDA de 1997 permite que los productores de medicamentos diseminen información válida –como artículos científicos publicados en revistas con revisión por pares– sobre la seguridad y efectividad del uso off-label de productos que la FDA está evaluando, o evaluará, para ver si pueden incluir esa nueva indicación en el etiquetado. Además del auspicio de la formación médica continuada, una estrategia clave de la industria farmacéutica para la promoción de medicamentos entre los prescriptores consiste en difundir artículos publicados sobre estos usos por fuera del prospecto. Con mucha frecuencia estos ensayos no son de buena calidad. Viva la olanzapina En diciembre de 2006, el New York Times (NYT) publicó un informe sobre el ocultamiento de datos de efectos adversos de la olanzapina. En esa misma oportunidad se comentaba sobre la promoción de usos por fuera de las indicaciones aprobadas (“off label”) de Zyprexa en el marco de una campaña llamada “Viva Zyprexa”, que comenzó en Orlando, Florida, a fines del año 2000. Su objetivo era estimular a los médicos para que prescribieran Zyprexa para ancianos con síntomas de demencia, una indicación para la que no estaba autorizado. La olanzapina no está autorizada para trastornos de la conducta y síntomas psiquiátricos en la demencia. Como parte de la campaña, la compañía creó perfiles de hipotéticos pacientes que consideraban candidatos para consumir el antipsicótico, e instruyó a los visitadores para que los discutieran con los médicos. Uno de los pacientes hipotéticos era una mujer veinteañera con síntomas de esquizofrenia, y el otro era un hombre de unos cuarenta años que parecía tener trastorno bipolar. El tercer perfil mostraba a Martha, una mujer viuda con un hijo adulto “que vive de forma independiente y que ha sido su paciente durante un tiempo”. Martha sufría agitación y trastornos del sueño, pero sin paranoia o manía, síntomas típicos de personas con esquizofrenia o trastorno bipolar. Uno de los documentos sugería que la demencia debía ser el primer mensaje que debían instalar los visitadores médicos, para discutir con los profesionales de atención primaria la prescripción de Zyprexa. De acuerdo a los documentos, la campaña fue un éxito: en marzo de 2001, tres meses después de su comienzo, habían conseguido 49.000 nuevos usuarios. Como en el período de 1999 a 2002 las ventas en los Estados Unidos pasaron de US$ 1.500 millones a US$ 3.000 millones, en 2002 cambiaron el nombre de la campaña dirigida a médicos de familia por “Zyprexa Limitless” (Zyprexa sin límites). Esta vez el objetivo fue ampliar el uso en los pacientes con trastorno bipolar leve que previamente habían sido diagnosticados con depresión. Zyprexa sólo está autorizado para los períodos de manía del trastorno bipolar. ¿Cuál es el problema? Desde el año 2004 hasta la actualidad numerosas agencias reguladoras han advertido en contra de este uso, ya que datos procedentes de ensayos clínicos mostraron un incremento de riesgo de accidente cerebrovascular para los antipsicóticos atípicos olanzapina y risperidona y un aumento de mortalidad para olanzapina en pacientes ancianos con demencia. Posteriormente, en el año 2005, un metanálisis de 17 ensayos clínicos con antipsicóticos atípicos realizado por la FDA mostró un aumento de la mortalidad en pacientes ancianos con demencia que recibían antipsicóticos atípicos para el tratamiento de los síntomas psicóticos o alteraciones del comportamiento. Luego se publicaron diversos estudios observacionales, algunos de los cuales, con las limitaciones inherentes a este tipo de estudios, mostraban un incremento de mortalidad en este grupo de población asociado también a antipsicóticos clásicos. Finalmente, en el 2008, a través de la publicación de dos estudios de cohortes se llegó a la conclusión de que el uso de antipsicóticos clásicos en pacientes ancianos con demencia se asocia con un incremento de mortalidad, pero que no se dispone de datos suficientes para establecer diferencias de riesgo entre antipsicóticos clásicos y atípicos o entre antipsicóticos individuales. Sin embargo, aún quedan varias preguntas por responder. Sin duda este grupo de pacientes constituye un desafío para su tratamiento debido a las escasas herramientas concretas disponibles. Pero el hecho de establecer campañas dirigidas específicamente hacia ellos pone en un riesgo innecesario a muchos pacientes. El resonado caso del Neurontin (gabapentina) Las causas de este éxito habrían pasado desapercibidas si no fuera por un capricho del destino. Un joven biólogo, David Franklin, fue a trabajar a Parke-Davis el 1 de abril de 1996 y se dio cuenta de que estaba participando en acciones ilegales de promoción comercial. Seis días después de explicarle el estatus legal de la promoción “off label”, un ejecutivo de Parke-Davis le dijo a Franklin: “Te quiero allá, todos los días vendiendo Neurontin… Sabemos que Neurontin no va a crecer como terapia adyuvante; además, ahí no es donde se encuentra el dinero. El manejo del dolor, ese es el que da dinero. La monoterapia [para epilepsia], eso si que es dinero… No podemos esperar a que los médicos pregunten; necesitamos salir y decírselo de antemano. Las cenas, los programas de educación médica continua y las consultorías funcionan, pero no hay que olvidar el cara a cara. Ahí es donde tenemos que estar, sosteniéndole la mano y susurrándole en el oído, Neurontin para el dolor, Neurontin para la monoterapia, Neurontin para bipolares, Neurontin para todo. No quiero ver a un solo paciente que suspenda el tratamiento con Neurontin antes de que al menos tome 4.800 mg/día. No quiero escuchar nada de la seguridad, ¿ha tomado Neurontin? Cada uno de ustedes debería tomar uno para comprobar que no pasa nada, es un gran medicamento.” 1 Tres meses después, Franklin dejó la compañía y presentó una demanda, en la que la acusaba de falsedades en la promoción de Neurontin para indicaciones no aprobadas.
Así, entre 1994 y 2000, Warner-Lambert lo promociona para migraña, déficit de atención infantil, trastorno bipolar… indicaciones no aprobadas por no existir pruebas adecuadas. Este éxito en ventas produjo en el año 2003 más de 2.200 millones de euros en ventas, de los cuales el 90% de las recetas correspondía a indicaciones no aprobadas. Finalmente, el 13 de mayo de 2004, Warner- Lambert acordó declararse culpable y pagar más de US$ 430 millones para resolver las responsabilidades civiles y penales. El caso Neurontin ha puesto en evidencia los mecanismos de acción de una campaña de mercadeo, sus objetivos y estrategias, tácticas y programas, y la participación de médicos e instituciones. La campaña utilizó sistemáticamente el engaño y la desinformación para crear una base de evidencias sesgadas y manipular las creencias de los médicos y su comportamiento a la hora de prescribir. Reclutaron, entrenaron y pagaron a médicos locales como ponentes en programas de “venta de igual a igual”, que la compañía consideraba como “uno de los modos más efectivos de comunicar nuestro mensaje”. Captaron líderes académicos a través de becas de educación e investigación, y oportunidades de charlas; algunos recibieron hasta US$ 158.250 en cuatro años. También se promovieron ensayos de siembra en indicaciones no aprobadas, se retrasó la publicación de algunos estudios (“negativos”) y se encargaron artículos a autores fantasma. No se encontró que los métodos de promoción fueran ilegales, lo ilegal fue promover una prescripción por fuera de las indicaciones aprobadas. Así pues, la importancia de este caso se centra, en gran medida, en que destapa métodos de promoción de la industria que pueden ser extensos, pero que siguen sin percibirse, dado que raramente se procesa a compañías por promoción ilegal. La situación en Argentina La prescripción para indicaciones no aprobadas podría aceptarse de acuerdo a la ley 17.132 de Ejercicio de la Medicina, según su articulo 2°. Según esta interpretación se “podría” utilizar medicamentos para indicaciones diferentes a las oficialmente aprobadas siempre que sea para casos en que está en juego la vida del paciente y no hayan sido de utilidad los tratamientos habituales para el problema de salud en cuestión. Sin embargo, este uso está restringido por el articulo 20 inc. 7 y 8, según los cuales: “queda prohibido a los profesionales… aplicar procedimientos que no hayan sido presentados o aprobados en centros universitarios o científicos reconocidos” o “practicar tratamientos personales utilizando productos… no autorizados por la Secretaría de Estado de Salud Pública”. Es decir que el uso para indicación “off label” fuera de las indicaciones aprobadas debe sustentarse en información bibliográfica sólida. En nuestro país poco tenemos documentado sobre el uso “off label” y mucho menos las tácticas de promoción dirigidas en ese sentido. Sólo hasta hace muy poco tenemos una regulación que aborde el tema específicamente, la Resolución 627/2007 del ministerio de Salud a través de su Art. 3º, inciso c, que dice que la promoción debe ceñirse a las indicaciones aprobadas. También en el mismo sentido se expresa el Proyecto de Ley del “Código de Ética para la Promoción del Medicamento”, aprobado por la cámara de diputados el 13 de diciembre de 2006. Conclusiones En el caso de nuestro país debería aprovecharse la experiencia para fortalecerse la fiscalización de las nuevas reglamentaciones vigentes. Casos como los de la olanzapina y de la gabapentina ofrecen la oportunidad de replantearse este debate entre todos nosotros y quizás impulsar este tipo y otras acciones que propicien regulaciones más estrictas y de efectivo cumplimiento que tengan como principal objetivo el cuidado y la seguridad de los ciudadanos. Bibliografía 1 Stafford RS. Regulating off-label drug use - rethinking the role of the FDA. N Engl J Med 2008;358:1427-9. *Miembro del Gapurmed. |